玻璃体是一种无色透明、凝胶状的组织,充满于晶状体、睫状体和视网膜所构成的玻璃体腔,占眼球内容物的4/5,约4.5ml。玻璃体的主要成分是水和凝胶,有粘弹性和抗压缩性,代谢缓慢,不能再生。其重要的生理功能表现为不仅能对相邻的组织起支撑、减震和代谢的作用,还是重要的屈光组织。玻璃体与其他组织一样经历胚胎发育、生长衰老的过程,其结构与生理功能也会发生相应的变化。如果相邻的组织出现严重的病理改变,也将影响到玻璃体的结构与功能。
玻璃体变性
玻璃体的变性可以是某些遗传性因素或者眼部的某些病理性因素引起,也可因为年龄增加而发生老年性的改变。
一、星状玻璃体变性
(一)概述
星状玻璃体变性多见于老年患者,常单眼发病,偶尔可见双眼发生者。发病原因不明,有文献资料提示与糖尿病相关。
(二)诊断标准
1.眼底镜检查可发现玻璃体腔内均匀分布的白色小球状的悬浮物,这些小球状物附着于玻璃体纤维上,可随着眼球的运动作轻度移动。利用间接眼底镜或者裂隙灯前置镜检查尤为明显(图4 - 126)。

2.不伴有玻璃体的液化。
3.病理检查可发现这种白色的小球是含钙的脂质体。
(三)治疗原则
本病不会引起患者的视觉障碍,因此不需要特殊治疗。但如果合并其他眼底疾病时需要进行玻璃体切割手术,以便进行眼底疾病的治疗。
二、闪辉性玻璃体液化
(一)概述
又称为胆固醇沉着症,多见于反复的玻璃体出血及眼内慢性炎症的患者。
(二)诊断标准
1.眼内可见大量黄白色、金色或者多彩的胆固醇结晶,这些结晶体大小不等,随着眼球运动幅度大,可进入前房内,当眼球停止运动后,结晶体下沉至眼球的下方(图4 - 127)。
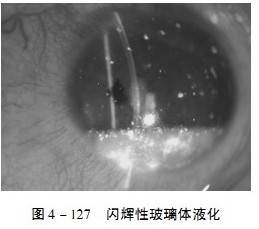
2.玻璃体液化程度明显。
3.常合并有其他眼部疾病的表现。
(三)治疗原则
闪辉性玻璃体液化不需要特殊治疗,主要是针对原发病治疗。
三、玻璃体液化、后脱离
(一)概述
玻璃体液化、后脱离是玻璃体的老龄化的改变。由于种种原因导致玻璃体代谢发生变化,玻璃体内的透明质酸分子发生降解,导致玻璃体内的胶原纤维网发生塌陷,水分析出,凝胶特性发生改变,称为玻璃体液化。玻璃体发生液化后,对视网膜的支撑作用减弱,导致玻璃体后皮质与视网膜发生分离,称为玻璃体的后脱离。
(二)诊断标准
1.患者大多会出现眼前半透明性的飘浮物,位置不固定,会随着眼球的运动而发生一定的移动,少部分患者会出现眼前闪光感。
2.裂隙灯检查会发现浓缩的玻璃体皮质和液化的暗腔。由于玻璃体与视盘边缘有紧密的粘连,二者分离后会在视网膜前出现一个与视盘大小相当的混浊物,称为Weiss环(图4- 128)。
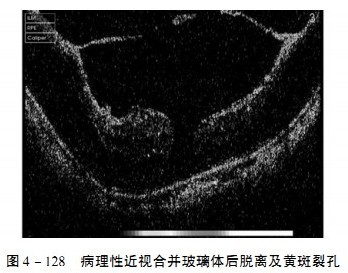
3.发生急性玻璃体后脱离时可撕裂视网膜浅层血管,导致玻璃体内积血。如果合并有异常的玻璃体视网膜粘连,在玻璃体后脱离可引起视网膜裂孔发生。
(三)治疗原则
1.单纯的玻璃体后脱离不需要治疗。
2.合并有玻璃体视网膜异常粘连病变的,需要定期严密随访观察。
(四)治愈标准
屈光间质改善,玻璃体对视网膜的牵引力消除,视网膜继发性损害修复。
玻璃体积血
一、概述
玻璃体本是一种无血管的凝胶样组织,通常由于临近组织的病理性改变,导致血液进入玻璃体腔,引进玻璃体积血。血液进入玻璃体后会改变玻璃体的透明性,并促进玻璃体的变性。引起玻璃体积血的原因很多,除了外伤与手术因素之外,常见的原因还有:
1.视网膜血管性疾病如增殖性糖尿病视网膜病变、视网膜静脉阻塞、视网膜血管炎等。
2.眼内炎症性疾病由于炎症导致血——视网膜屏障破坏,血液可进入玻璃体内:也可因为炎症导致玻璃体变性,引起玻璃体继发性收缩牵引,撕裂视网膜的血管引起出血。如部分感染性眼内炎Behcet、急性视网膜坏死综合征(ARN)等。
3.某些老龄化疾病及先天性病症引起黄斑视网膜下新生血管膜 ( CNV)增生类疾病,如老龄性黄斑变性(AMD)、视网膜裂孔上血管桥断裂出血、先天性视网膜襞裂、先天性视网膜皱襞等。
4.眼内肿瘤如视网膜血管瘤等。
二、诊断标准
1.少量玻璃体出血时患者的视力不受明显的影响,但多有飞蚊症样的症状出现。但大量玻璃体出血患者的视力下降迅速、严重,甚至患者可详述发病的整个过程。
2.裂隙灯及前置镜检查可发现玻璃体内有鲜红或混黄变性的血影细胞。
3.出血量少的患者可以看到视网膜的原发性疾病,但出血量大的患者无法看见眼底病变,甚至仅能看见红黑色的反光。
4.B超能了解玻璃体积血的程度、视网膜的状态及玻璃体视网膜的相互关系,有助于原发病的判断及治疗方式的选择。
5.视电生理检查有助于了解视神经、视网膜功能状态,判断预后。
6.详细检查对侧眼的状态,有助于对出血原因的判断。
三、治疗原则
1.出血量少的患者主要是针对原发病的治疗。早期可使用活血化瘀类中成药促进积血的吸收,晚期可使碘剂助玻璃体混浊吸收。
2.对于出血原因及视网膜状态均不明确的患者,在进行促进玻璃体积血吸收治疗的同时,要定期严格的随访,要通过眼底镜检查或B超检查掌握视网膜的状态,一旦发现视网膜脱离要及时进行手术治疗。
3.对于大量出血的患者,玻璃体内的积血难以吸收,并且常引起玻璃体的严重变性,因此经过短期治疗(发病后2周为宜)无效后即可考虑进行玻璃体手术。
四、治愈标准
玻璃体积血吸收,屈光间质改善,引起出血的原发病被控制。
玻璃体炎症
一、概述
玻璃体的炎症可分为感染性炎症和非感染性炎症。其中感染性玻璃体炎症根据感染源的来源分为外源性和内源性,在临床上以外源性感染最为常见。又可根据致炎因子分为细菌性、真菌性、病毒性炎症。外源性感染性玻璃体炎症多见于外伤、手术之后,因为致炎因子的不同,潜伏期及发病过程不同,其中细菌性炎症发病最为迅速、严重,而真菌性炎症发病过程较慢。非感染性玻璃体炎症常由于葡萄膜与视网膜的炎症影响所致,起病的过程和严重程度与原发病性质和严重程度密切相关。
二、诊断标准
1.感染性玻璃体炎可合并不同程度的眼前节的炎症。玻璃体内可看见浮游的炎症细胞及渗出物,玻璃体可出现液化和浓缩相间的不均匀状态。严重感染性玻璃体炎症可出现玻璃体内积脓,视网膜乳头充血、水肿,视网膜水肿、出血,视网膜血管闭锁等改变。
2.非感染性玻璃体炎可出现与感染性玻璃体炎相类似的改变常可见葡萄膜与视网膜原发性炎症疾病的表现。
3.B超可了解玻璃体炎症的程度和视网膜状态。
4.玻璃体穿刺培养或诊断性玻璃体切除有助于病因学诊断。
三、治疗原则
一般玻璃体炎症应针对病因治疗。感染性玻璃体炎症在早期要进行玻璃体腔内注射足量、敏感药物以控制炎症的发展,晚期需要进行玻璃体切割手术。非感染性玻璃体炎症一般随着原发病的治愈而逐渐好转,遗留下不可吸收的玻璃体混浊需要进行玻璃体切割手术。
四、治愈标准
玻璃体炎症细胞与渗出吸收,屈光间质改善,视网膜继发性损害稳定。
家族性渗出性玻璃体视网膜病变
一、概述
家族性渗出性玻璃体视网膜病变(FEVR)是常染色体显性遗传疾病,病变表现为以颞侧视网膜无血管化为特点,双眼患病,病变程度可不对称,轻者可无临床症状。
二、诊断标准
1.患者发病年龄早,常在新生儿或青春期发病。
2.早期表现为周边视网膜无血管,以后逐渐形成新生血管及纤维血管增生,也可出现视网膜下出血、渗出及渗出性视网膜脱离,也出现玻璃体腔内积血。晚期可出现视网膜皱褶、牵引性视网膜脱离或牵引裂孔性视网膜脱离。
3. FFA早期显示周边无灌注区,血管被异常拉伸、细长,在有灌注与无灌注交界区可见动静脉的异常吻合。新生血管可出现荧光渗漏(图4 - 129,图4- 130,图4-131)。
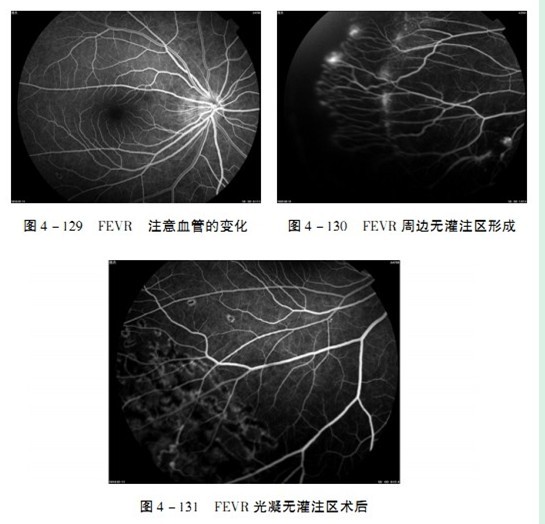
4.B超可了解玻璃体及视网膜的异常扶态。
5.应与早产儿视网膜病变( ROP)相鉴别。本病患者均无早产病史,无过度吸氧史,总体预后好于ROP患儿。
三、治疗原则
1.早期轻度患者应及时进行无血管区视网膜光凝或冷凝。
2.轻度牵引性视网膜脱离的患者可试行冷凝联合巩膜扣带手术。
3.合并玻璃体积血或明显牵引性视网膜脱离的患者应行玻璃体手术。
四、痊愈标准
无灌注区进行了充分的凝固性治疗,缺血状态纠正,视网膜继发性损害被修复或稳定。
玻璃体发育性异常
玻璃体的胚胎发育经历了原始玻璃体、次级玻璃体、第三玻璃体三个阶段。从胚胎的第六周原始玻璃体开始退化,次级玻璃体开始发育。体积逐渐增大的次级玻璃体将原始玻璃体向中央、两侧及前端挤压,并最终导致原始玻璃体内血管完全退化。被挤压于晶体后表面的原始玻璃体呈网盘状,由于密度高被称为玻璃体的前界膜,而被挤压于中央区的原始玻璃体逐渐形成Clo-quet管。第三玻璃体于胚胎的第三月开始,从睫状体区的神经上皮分泌出次级玻璃体,并最终形成晶状体悬韧带。如果在胚胎发育的过程中原始玻璃体内的血管不能完全消退,多种玻璃体的发育异常,临床上常见有永存玻璃体动脉、永存原始玻璃体增生症等。
(一)永存玻璃体动脉
1.利用裂隙灯前置镜或间接检眼镜能发现玻璃体的中央区有一条灰白色的条索,条索内可见退化或通畅的玻璃体动脉。
2.条索的前端可附着于晶体后囊下,形成致密的白斑,称为Mittendorf斑。后端附着于视乳头,称为了Bergmeister乳头。
3.永存玻璃体动脉一般不影响视力,无需处理。
(二)永存原始玻璃体增生症( PHPV)
分为前部型与后部型。
1.前部型
(1)出生后即可发现患儿瞳孑L区有白色的纤维血管膜,以后并发白内障,白瞳症表现更加明显。
(2)患儿可伴有真性小眼球、浅前房,睫状突可由于牵引伸长进入瞳孔区内。可并发白内障或继发闭角性青光眼。
(3)必须与视网膜母细胞瘤和其他原因引起的白瞳症相鉴别。
(4)本病需要进行玻璃体手术治疗。治疗以后眼球或可保留有限的视功能,继发性损害被控制,维持眼球基本形态与结构。
2.后部型
(1)可单独发生,也可合并前部型。若单独发生,晶体后无纤维血管膜形成。
(2)可发现起源于视盘的纤维血管组织向周边伸展,牵引其下面的视网膜形成视网膜皱襞。
(3)若无其他的并发症不宜手术治疗。
增生性玻璃体视网膜病变
一、概述
增生性玻璃体视网膜病变( PVR)是特指由于7L源性视网膜脱离所引起的增殖性玻璃体视网膜的病变。常发于孔源性视网膜脱离或孔源性视网膜脱离手术失败之后,并且是孑L源性视网膜脱离手术失败的重要因素之一。PVR的发生机制目前尚不明了,现研究表明是多细胞与多细胞因子共同参与、相互作用的结果,其中移行于玻璃体腔内视网膜色素上皮细胞( RPE)具有重要的作用。研究表明,RPE细胞进入玻璃体腔后,在一系列因素的作用下发生成纤维母细胞样化生,分泌胶原纤维,在玻璃体和视网膜的前后表面形成增生性纤维膜,这些纤维膜继发性收缩引起视网膜僵硬、固定。
二、诊断标准
1983年美国视网膜协会对PVR进行了统一的命名并制定了分级标准。尽管这种分级标准没有全面地表述PVR的病理特点,但它简洁、明了,对临床工作具有重要的指导意义。根据该分级标准,PVR共分为四期(表4-4)。

三、治疗原则
PVR的患者均需要进行手术治疗。原则上PVR A、B、及少数CI期的患者可以行巩膜扣带手术,其他更复杂的患者应进行玻璃体手术。但随着玻璃体手术技术的发展,其优越性日益被人们所认识,因此,巩膜扣带手术及巩膜扣带术联合玻璃体手术的适应证越来越少,合并PVR的孔源性视网膜脱离的患者行玻璃体手术的适应证正日益扩大。因此在制定手术方式的时候要绪合患者的实际情况、术者的技术能力及设备条件综合进行考虑。
四、治愈标准
视网膜实现解剖复位,眼球或保留有限的视功能,继发性损害被控制,维持眼球基本形态与结构。



